El enlace de por puente de hidrógeno en realidad no es un enlace propiamente dicho, sino que es la atracción experimentada por un átomo electronegativo y un átomo de hidrógeno que están formando parte de distintos enlaces covalentes polares.
El átomo con mayor electronegatividad atraerá hacia si los electrones del enlace, formándose un dipolo negativo, mientras que el átomo de hidrógeno, al ceder parcialmente sus electrones, genera un dipolo de carga positiva en su entorno. Estas cargas opuestas se atraen.
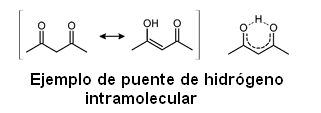
El puente de hidrógeno es un caso especial de la interacción dipolo-dipolo. El enlace por puente de hidrógeno puede ser intermolecular (en el caso del agua por ejemplo) o puede darse también dentro de una misma molécula, siendo denominado en este caso puente de hidrógeno intramolecular.
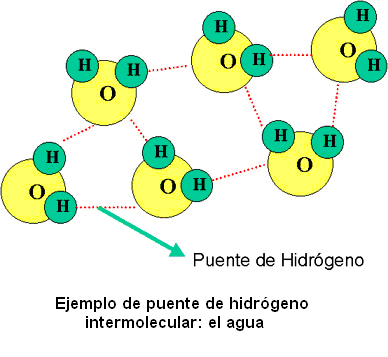
Además, cada molécula de agua puede estar unida con cuatro moléculas más, mediante puentes de hidrógeno, ya que cada oxígeno puede formar, mediante su par libre de electrones, dos puentes de hidrógeno, y además, los dos átomos de hidrógeno de la molécula forman dos puentes más. Esta multitud de enlaces por puente de hidrógeno es lo que brinda cualidades especiales al agua.
Los enlaces de hidrógeno intramoleculares intervienen en la formación de las estructuras secundarias, terciarias y cuaternarias de las proteínas y en la estabilidad de los ácidos nucleicos. En éstos últimos, los puentes de hidrógeno son los que unen los pares de bases de las dos cadenas de ADN, formando la doble hélice.
La fuerza del puente de hidrógeno es por lo general entre diez y veinte veces menor que la de un enlace covalente promedio. Aún así, este tipo de enlace comparte algunas características con el enlace covalente, por ejemplo, provoca distancias interatómicas menores que la suma de los radios de Van der Waals.
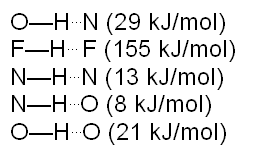
Los átomos que más frecuentemente se encuentran formando puentes de hidrógeno son el nitrógeno, oxígeno, flúor, cloro, entre otros. A continuación se detallan algunos valores de la fuerza de puentes de hidrógeno:
Un subtipo de enlace de hidrógeno es el puente de hidrógeno simétrico, en el cual el átomo de hidrógeno se encuentra equidistante del átomo al cual está unido covalentemente y del átomo con el cual está formando el enlace. Es un enlace mucho más fuerte que los puentes de hidrógeno comunes, con orden de enlace 0.5. Se ha observado este tipo de puente en hielo a altas presiones.
Lee todo en: Enlace por puente de hidrógeno | La Guía de Química http://quimica.laguia2000.com/conceptos-basicos/enlace-por-puente-de-hidrogeno#ixzz2QGYlgprJ
Chido prro
ResponderEliminar